Guérir grâce à la transplantation de microbiote fécal
Par Delphine Roucaute et Pascale Santi Publié le 03 juillet 2023 à 18h30, modifié hier à 14h54
Temps de Lecture 10 min.
Enquête
Médiatisée depuis quelques années, même si elle reste pratiquée à un niveau encore confidentiel, la greffe de microbiote guérit certaines infections bactériennes. Et les recherches pour d’autres indications que les pathologies gastro-intestinales se multiplient.
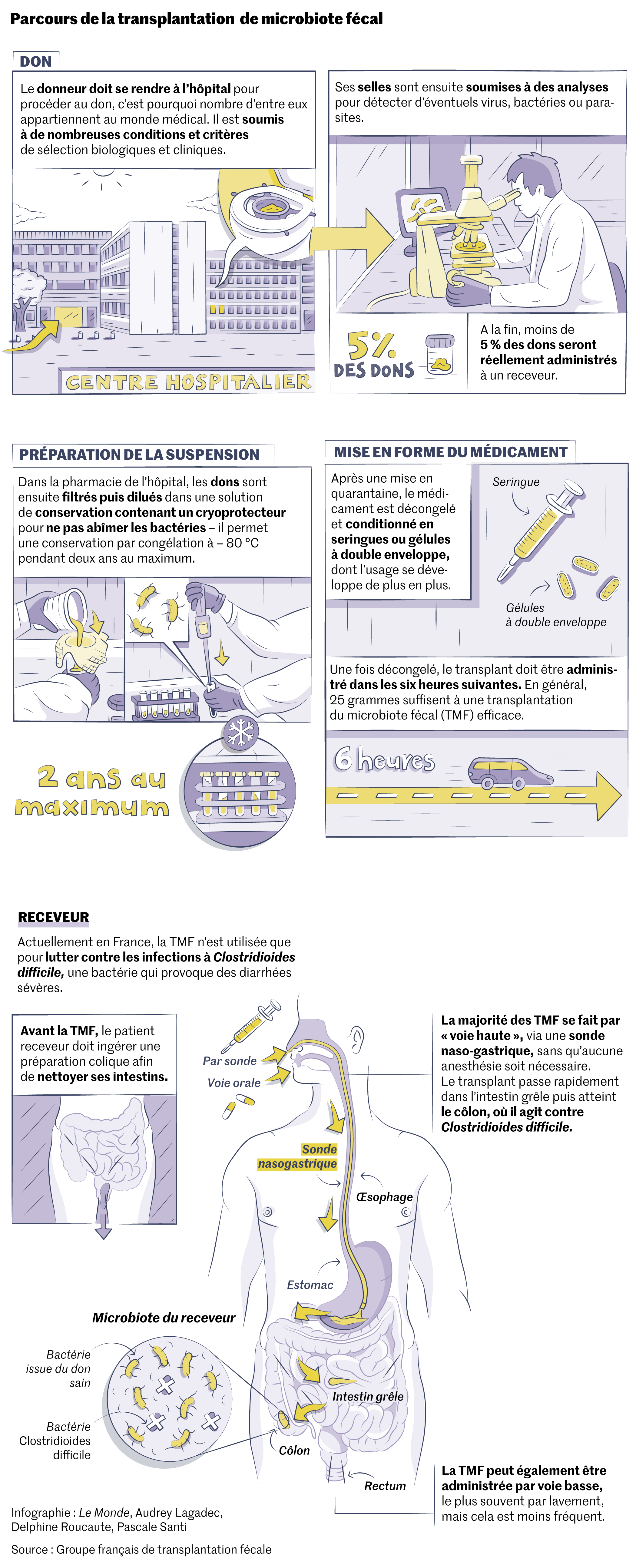
Le caca peut aussi permettre de guérir. Ce jeudi 8 juin, au service de gastro-entérologie de l’hôpital Saint-Antoine (Assistance publique-Hôpitaux de Paris, AP-HP), Benjamin – qui n’a pas souhaité donner son nom –, développeur de 30 ans, se sent un peu fatigué mais semble soulagé. Dans la matinée, Sandrine Truong, infirmière coordinatrice de transplantation de microbiote fécal (TMF), a injecté deux seringues remplies de selles humaines filtrées (100 millilitres, soit 25 grammes) dans ses intestins à l’aide d’une sonde naso-gastrique. Il a dû suivre un traitement antibiotique durant quatre jours, afin que ses intestins puissent recevoir ce produit, et faire un lavement la veille.
Lire aussi : Article réservé à nos abonnés Le microbiote fécal peut-il être considéré comme un médicament ?Ajouter à vos sélections
Ajouter à vos sélections
Deux semaines plus tard, ses symptômes très invalidants ont complètement disparu. Il souffrait, depuis fin février, d’une infection à Clostridioides difficile, autrefois appelée Clostridium difficile – la fameuse C. difficile, une bactérie qui fabrique une toxine altérant la paroi intestinale. Cette infection provoquant de très sévères diarrhées s’est déclarée de manière opportuniste, à la suite de plusieurs traitements antibiotiques qui ont fragilisé son microbiote intestinal – l’ensemble des micro-organismes (principalement des bactéries) qui colonisent le tube digestif. Deux nouvelles cures n’étant pas venues à bout de cette bactérie multirésistante, Benjamin a été orienté vers l’hôpital Saint-Antoine, pionnier de la TMF depuis une dizaine d’années. Les bactéries saines du donneur permettent de rétablir l’équilibre des bactéries dans l’intestin du receveur et de prévenir les réinfections.
Il existe plusieurs hypothèses pour expliquer l’efficacité de la TMF. Le microbiote du donneur pourrait se développer chez le receveur et empêcher la bactérie infectieuse de recoloniser le côlon. D’autres mécanismes peuvent entrer en jeu concernant les interactions entre donneurs et receveurs.
« J’ai dû prendre des antidiarrhéiques pendant deux mois pour traiter de fortes diarrhées aqueuses qui m’obligeaient à rester chez moi », confie Benjamin, qui souffrait aussi de puissantes douleurs abdominales. Dans certains cas, ce genre d’infection s’accompagne aussi d’une perte d’appétit et de nausées. Il n’a eu aucune réticence à accepter la greffe de selles, tout en admettant que « [s]es copains se sont moqués de [lui] au départ, et étaient un peu sceptiques ». Le plus gênant pour le jeune homme a surtout été de garder la sonde durant plusieurs heures, sans anesthésie. La TMF peut également être administrée par voie basse, le plus souvent par lavement, mais cela est moins fréquent. Désormais, la prise de gélules, mieux acceptée par les patients, se développe.
Sept centres en France
L’infection récidivante à C. difficile est la seule indication validée à ce jour pour recevoir une transplantation fécale. Chaque année, elle touche environ 120 000 nouvelles personnes en Europe et provoque 4 000 décès.
Le Monde Guides d’achat Aspirateurs robotsLes meilleurs aspirateurs robotsLire
Selon une étude parue, en 2021, dans The Lancet, près de 2 000 TMF ont été réalisées en Europe en 2019, couvrant seulement 10 % des indications recommandées. En France, cette infection entraîne des milliers d’hospitalisations tous les ans. Mais, si le nombre de TMF ne cesse de croître et a doublé en cinq ans, il reste à un niveau confidentiel, avec 146 transplantations réalisées en 2022, selon Nicolas Benech, gastro-entérologue aux Hospices civils de Lyon, s’appuyant sur les données des sept centres français.
Cette nouvelle thérapeutique a été intégrée dans les recommandations des autorités sanitaires américaines et européennes après la publication, en 2013, du premier essai clinique randomisé mené par une équipe de chercheurs aux Pays-Bas. Plus de 80 % des patients ont vu leur diarrhée associée au C. difficile disparaître après le premier transplant. Un succès tel que les chercheurs ont mis un terme à leur étude plus tôt que prévu, les patients recevant simplement un antibiotique se plaignant de ne pas bénéficier de ce traitement aux résultats exceptionnels.
En France, la pratique a réellement commencé à se développer à partir de 2014. L’Agence nationale de sécurité du médicament et des produits de santé (ANSM) a défini le microbiote fécal comme un médicament, cadre réglementaire qui prévaut encore aujourd’hui.
Vous pouvez partager un article en cliquant sur les icônes de partage en haut à droite de celui-ci.
La reproduction totale ou partielle d’un article, sans l’autorisation écrite et préalable du Monde, est strictement interdite.
Pour plus d’informations, consultez nos conditions générales de vente.
Pour toute demande d’autorisation, contactez syndication@lemonde.fr.
En tant qu’abonné, vous pouvez offrir jusqu’à cinq articles par mois à l’un de vos proches grâce à la fonctionnalité « Offrir un article ».
Pour préparer les transplants, les selles du donneur sont mises en suspension, filtrées, puis congelées à – 80 °C le temps de réaliser les tests biologiques. Elles ne seront décongelées que quelques heures avant l’administration pour être mises en forme, prêtes à l’emploi, dans un équipement réservé à cet usage. On est loin des années 2010 et des débuts de la TMF, où « les suspensions étaient réalisées avec les moyens du bord, le jour même de la transplantation », se souvient Anne-Christine Joly, responsable de la production des transplants fécaux à la pharmacie de l’hôpital Saint-Antoine.
Les premières années, cet établissement, pionnier en la matière, réalisait des TMF principalement grâce à des donneurs dans la famille des patients. Le centre de transplantation fécale de l’AP-HP a été créé en 2020, à l’hôpital Saint-Antoine. Il recrute des donneurs, prépare, stocke et administre des transplants fécaux pour toute l’Ile-de-France et parfois au-delà.
Seuls 5 % des dons conservés
« Les centres de référence commencent à voir la demande augmenter, mais il faudrait faire au minimum dix à vingt fois plus de TMF, estime Harry Sokol, gastro-entérologue à l’hôpital Saint-Antoine et président du Groupe français de transplantation fécale. Les médecins ne sont pas assez informés de l’existence et de la disponibilité de ce traitement. »
« Les donneurs, c’est l’aspect le plus compliqué de la TMF, poursuit celui qui est l’auteur d’une bande dessinée, Les Extraordinaires Pouvoirs du ventre (De Boeck, 2022). Aujourd’hui, on fait surtout appel à des dons, qui nécessitent des campagnes régulières, mais c’est un don plus compliqué que celui du sang. » C’est, en effet, un domaine encore relativement peu connu du grand public. « Beaucoup de donneurs sont recrutés via les affichages dans les établissements de santé et à la fac ; ils viennent donc beaucoup du milieu médical ou paramédical », relève, de son côté, Anne-Christine Joly.
C’est le cas de Théo (qui a souhaité rester anonyme), 26 ans, qui travaille au CHU de Nantes en tant qu’attaché de recherche clinique. « J’entendais souvent parler des difficultés de mes collègues à recruter, je me suis dit que j’avais moins de contraintes logistiques que d’autres », raconte le jeune homme.
Le don doit, il est vrai, se faire dans le service de gastro-entérologie de l’établissement, à un horaire spécifique. Ce détail peu commode peut représenter un frein pour de nombreux volontaires mais ne dérange pas Théo, qui se dit « réglé comme une horloge ». S’il surprend des regards étonnés quand il évoque cette démarche « moins noble que le don du sang », il ne désespère pas de convaincre des proches de passer le cap.
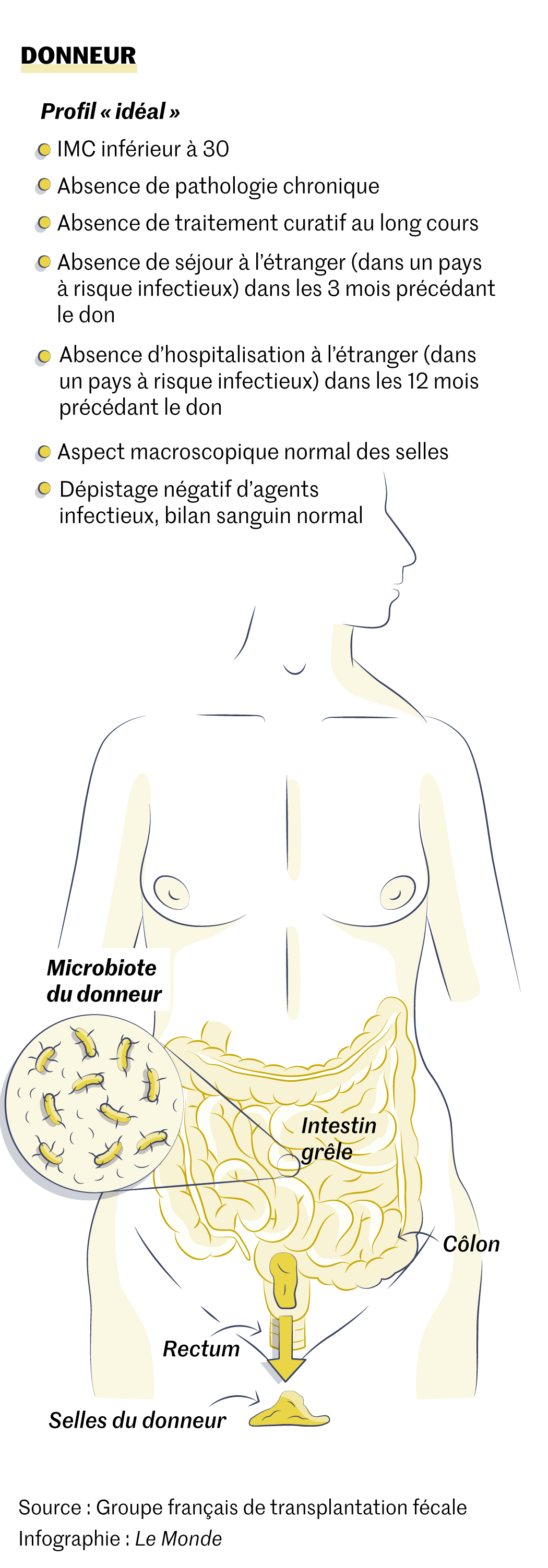
Tout le monde peut-il être donneur ? La sélection se fait exclusivement sur des critères de sécurité : avoir un indice de masse corporelle inférieur à 30, ne pas avoir de pathologie chronique ni avoir subi un traitement antibiotique récent ou s’être rendu à l’étranger dans les trois mois précédant le don. Les selles passent ensuite au tamis de nombreuses analyses pour vérifier qu’elles ne contiennent aucun virus, bactérie ou tout autre parasite passible d’infecter le receveur. Au total, les cliniciens estiment que seulement 5 % des dons sont conservés après ces tests.
Lire aussi : Article réservé à nos abonnés Une bactérie du microbiote combat les effets de la sous-nutritionAjouter à vos sélections
Ajouter à vos sélections
Quant à savoir si tous les microbiotes sains se valent… les études divergent. Certaines montrent qu’il n’y a pas d’« effet donneur », c’est-à-dire que le succès d’une transplantation sera le même quel que soit le donneur, notamment dans les infections à C. difficile.
Mais ce serait peut-être le cas pour d’autres pathologies. Certaines données témoignent d’un « effet receveur » qui pourrait être plus important, lié aux facteurs génétiques du patient, à son état inflammatoire avant la transplantation et à d’éventuelles réactions immunitaires. « On observe une forme de compatibilité en lien avec la capacité du microbiote du donneur à s’implanter chez le receveur », explique Harry Sokol, pour qui « l’idée d’un donneur universel tombe à l’eau ».
En théorie, on pourrait donc imaginer une médecine personnalisée, avec une sélection du donneur en fonction des particularités du patient à soigner. « Mais, en pratique, cela semble beaucoup trop compliqué d’ajouter encore de nouveaux critères de sélection, tranche sans hésitation Harry Sokol. Cela semble infaisable, en particulier pour les pathologies chroniques, qui exigent plusieurs greffes. »
Plusieurs essais cliniques en cours
En France, les autres usages de la TMF concernent essentiellement les indications compassionnelles, pour les patients en impasse thérapeutique. Les résultats les plus probants concernent la prise en charge de la maladie digestive du greffon contre l’hôte. Il s’agit d’une maladie grave qui survient lorsque les cellules souches saines d’un greffon attaquent les cellules de l’hôte. Elle est associée à une mortalité élevée. Une étude française, menée entre 2019 et 2022, a montré une baisse de 50 % du volume des selles à un mois chez 40 % des patients traités, un résultat considéré comme un succès. D’autres demandes compassionnelles concernent les personnes infectées par des bactéries multirésistantes (BMR), les atteintes digestives inflammatoires et les colites infectieuses persistantes. Les résultats sont ici plus mitigés.
De nombreuses études ont été lancées pour tester l’efficacité de la TMF sur d’autres pathologies. Pas moins de sept essais cliniques sont en cours dans des centres hospitaliers en France. Les pistes paraissent nombreuses, mais, pour l’heure, la prudence s’impose.
L’essai FeCeS, coordonné par Victoire de Lastours, infectiologue dans le service de médecine interne de l’hôpital Beaujon (AP-HP), à Clichy, a commencé à chercher des donneurs à la mi-juin et recrutera, à partir de septembre, 160 malades colonisés par des bactéries productrices de bêta-lactamases à spectre élargi ou des entérobactéries productrices de carbapénèmases, deux types de bactéries résistantes aux antibiotiques à l’origine d’infections courantes. « On pense que ces souches profitent de la dysbiose intestinale [le déséquilibre du microbiote] pour s’installer », explique Victoire de Lastours.
Pistes pour le traitement du cancer
Si l’on peut comprendre aisément le rôle que joue le microbiote fécal dans les infections, il est un champ d’application beaucoup plus étonnant. « Dans le domaine du cancer, des études ont montré qu’une greffe de selles, venant de patients répondant bien au traitement par immunothérapie, permet aux patients atteints de cancer d’améliorer leur réponse au traitement », explique l’oncologue Bertrand Routy, directeur du laboratoire d’immunothérapie et de microbiome du centre hospitalier de l’université de Montréal (Canada).
« On essaie de comprendre qui sont les malades ayant un microbiome intestinal [l’ensemble des génomes des micro-organismes composant le microbiote] favorable et sain pour le succès d’une immunothérapie contre le cancer, soit environ 50 % des patients, et quelles sont leurs bactéries », indique l’oncologue Lisa Derosa, codirectrice du programme Clinicobiome, la clinique du microbiome de l’Institut Gustave-Roussy, à Villejuif (Val-de-Marne). « On peut imaginer que, dans un horizon de quatre à cinq ans, au moment du diagnostic du cancer, on analysera le microbiote du patient pour guider le traitement », ajoute Bertrand Routy.
Lire aussi : Méfiez-vous des tests de microbiote, jugés peu fiables
Un essai randomisé, Picasso, soutenu par l’AP-HP, conduit par Caroline Robert, cheffe du service de dermatologie à Gustave-Roussy, et par Franck Carbonnel, chef du service de gastro-entérologie du CHU de l’hôpital Bicêtre (AP-HP), va comparer l’effet d’un médicament composé de selles de plusieurs donneurs auprès de 60 patients traités par immunothérapie pour un mélanome. Produit par la société lyonnaise MaaT Pharma, le médicament est administré par lavement. « Un autre médicament sous forme de gélules va également être testé auprès de patients ayant reçu une greffe de cellules souches et dans un essai pilote dans la maladie de Charcot », précise-t-on chez MaaT Pharma.
Par ailleurs, depuis 2012, plusieurs essais randomisés ont montré une certaine efficacité de la TMF dans le syndrome métabolique, caractérisé par un tour de taille important (en raison d’un excès de graisse abdominale), une hypertension ou une glycémie anormale. « Il existe néanmoins une grande variabilité dans l’importance des réponses », explique Judith Aron-Wisnewsky, médecin à la Pitié-Salpêtrière (AP-HP) et chercheuse à Sorbonne Université. « Les études récentes montrent l’importance des caractéristiques du microbiote du donneur dans la réponse métabolique, en fonction de sa grande diversité. En revanche, l’ensemble de ces études confirment que la TMF n’a aucun effet sur la réduction pondérale », poursuit Judith Aron-Wisnewsky.
« Solution qui fait rêver »
Enfin, concernant le syndrome de l’intestin irritable, aussi connu sous le nom de colopathie fonctionnelle, les experts restent très prudents, différentes études montrant des résultats discordants. Ce trouble du fonctionnement de l’intestin, qui touche environ 5 % de la population française et plus particulièrement les femmes, altère fortement la qualité de vie sans que l’on en connaisse encore précisément la cause, même si la dysbiose du microbiote digestif semble favoriser ces maux.
A l’hôpital Avicenne (AP-HP), à Bobigny, Jean-Marc Sabaté attend une dernière autorisation pour démarrer une étude visant à évaluer l’efficacité contre placebo de la TMF chez 124 patients atteints de formes sévères et réfractaires à au moins deux stratégies thérapeutiques. « Les patients ont vite le sentiment d’être arrivés au bout des traitements et envisagent parfois trop vite cette solution qui fait rêver, met en garde le gastro-entérologue. Mais il ne faut pas oublier que cela peut être dangereux. » Car le microbiote n’est pas composé que de bactéries, il contient une myriade de micro-organismes tels que les archées, levures, eucaryotes ou virus dont les multiples interactions restent à découvrir.
La médiatisation, ces dernières années, de la TMF a en effet soulevé beaucoup d’espoir chez des patients souffrant de pathologies très diverses, dont un lien plus ou moins étroit a été établi avec l’équilibre du microbiote intestinal. Autisme, dépression, troubles psychiatriques… Les domaines de recherche sur le microbiote dépassent largement la sphère gastro-intestinale et ouvrent des pistes prometteuses.
Les experts mettent toutefois en garde : la transplantation fécale n’a, pour le moment, fait ses preuves que sur de très rares pathologies et on ignore encore les conséquences possibles de ces transferts entre individus. Gare alors aux marchands d’espoir repérables sur les réseaux sociaux, proposant de fabriquer sa propre « soupe dorée », cette infusion de selles utilisée dans la médecine traditionnelle chinoise. La recherche devrait apporter, ces prochaines années, des propositions thérapeutiques plus larges.