Covid-19 : un traitement préventif pour les personnes peu réceptives aux vaccins autorisé en France (deux anticorps: tixagévimab et cilgavimab – Astra Zeneca – EVUSHELD*)
Ce traitement par anticorps vise à agir avant l’apparition de la maladie. Il doit suppléer la vaccination chez des personnes dont l’organisme réagit peu aux vaccins.
Le Monde avec AFP
Publié le 11 décembre 2021 à 19h12, mis à jour hier à 17h48
Temps de Lecture 1 min.
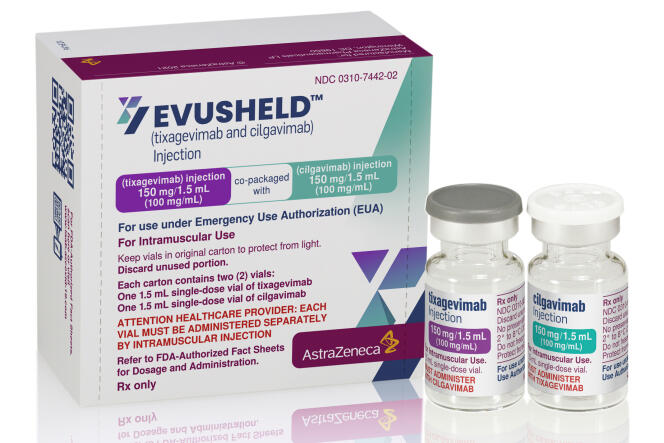
Les autorités sanitaires françaises ont autorisé l’utilisation préventive d’un traitement par anticorps contre le Covid-19, chez les personnes dont l’organisme résiste à la vaccination, à condition qu’elles présentent un risque élevé de forme grave. La Haute Autorité de santé (HAS) « donne son feu vert à l’utilisation [d’]Evusheld en prophylaxie pré-exposition pour des patients à très haut risque de forme sévère de Covid-19 », a annoncé vendredi 11 décembre au soir l’instance sanitaire.
Evusheld est un traitement par anticorps de synthèse développé par le laboratoire AstraZeneca. Il combine deux molécules, tixagévimab et cilgavimab, et se donne en deux injections successives. Contrairement à la plupart des traitements contre le Covid-19 par anticorps, qui sont destinés à des patients déjà hospitalisés pour éviter qu’ils ne développent une forme très grave de la maladie, Evusheld vise à agir avant l’apparition de la maladie, sur le même principe qu’un vaccin.
Ce traitement doit justement suppléer la vaccination chez des personnes dont l’organisme réagit peu aux vaccins. Il s’adresse aussi à celles qui ne sont pas éligibles à la vaccination pour des raisons médicales, notamment parce qu’elles risquent d’importantes réactions allergiques.
Lire aussi Les promesses d’un traitement préventif de longue durée d’action contre le Covid-19
Risques cardio-vasculaires
Parmi ces personnes, seules celles qui courent un risque élevé de forme grave du Covid-19 pourront bénéficier du traitement, selon la HAS, qui donne sa position quelques jours après que les autorités sanitaires américaines ont émis un avis semblable. Toutefois, contrairement à ces dernières, qui l’ont autorisé aux personnes de 12 ans et plus, l’autorité française limite l’usage de ce traitement aux personnes majeures.
Surtout, elle met en garde sur les risques cardio-vasculaires, identifiés lors des essais cliniques du traitement. Elle ne recommande donc pas Evusheld aux personnes qui ont au moins deux facteurs de risques sur ce plan, par exemple un diabète et une obésité. Or ces facteurs de risque recoupent souvent ceux d’une forme grave de Covid-19.
En tout état de cause, « les patients traités, notamment ceux qui ont des antécédents cardio-vasculaires, doivent être attentifs à l’apparition d’un symptôme cardio-vasculaire afin de consulter un professionnel de santé le cas échéant », conclut la HAS.
Le Monde avec AFP
Evusheld* autorisé en France en prévention du Covid19 pour les patients sévèrement immunodéprimés : six mois après son administration, il permet de diminuer de plus de 80% le risque de développer un Covid symptomatique.
- COVID19
- 11 décembre 2021
- https://renaloo.com/evusheld-autorise-en-france-en-prevention-du-covid19-pour-les-patients-severement-immunodeprimes/
✅ Très bonne nouvelle pour les patients greffés et dialysés mal protégés par la vaccination : Evusheld, le cocktail d’anticorps monoclonaux du laboratoire AstraZeneca dont nous vous parlions récemment, arrive en France.
Il vient d’être autorisé par la Haute Autorité de Santé en accès précoce en prophylaxie pré-exposition pour les patients sévèrement immunodéprimés.

Traitements contre le Covid-19 : la Haute Autorité de santé dit non à l’utilisation du Molnupiravir, l’antiviral de Merck et autorise l’Evusheld* d’Astra-Zeneca
La HAS a en revanche donné son feu vert à l’utilisation du nouveau traitement aux anticorps monoclonaux Evusheld, du laboratoire AstraZeneca.
Article rédigé par

franceinfoFrance TélévisionsPublié le 10/12/2021 20:41Mis à jour le 10/12/2021 21:06 Temps de lecture : 2 min.

C’est non. La Haute Autorité de santé (HAS) a refusé d’accorder une autorisation d’accès précoce au molnupiravir, un traitement antiviral contre le Covid-19 développé par le laboratoire Merck (MSD France) et que le gouvernement avait commandé, annonce-t-elle dans un avis rendu public vendredi 10 décembre.
Si elle assure que « les traitements médicamenteux » ont un rôle à jouer « notamment pour les personnes qui répondent mal ou pas à la vaccination ou qui n’y sont pas éligibles », elle estime néanmoins que celui-ci, commercialisé sous le nom de Lagevrio, n’est pas assez performant au regard de ce qui existe déjà et refuse donc sa distribution. « Les résultats d’efficacité avancés par le laboratoire sont moins bons que ceux des traitements disponibles : 30% de réduction des risques de progression vers la forme grave de la Covid-19 (…) alors que l’efficacité pour les anticorps monoclonaux casirivimab-imdevimab est d’environ 80% sur ce même critère ».
Le ministère de la Santé « prend acte »
Le traitement a pourtant été approuvé dans l’Union européenne pour une utilisation en urgence, avant son autorisation formelle de mise sur le marché. Il est également en cours de validation par les autorités sanitaires aux Etats-Unis.
La France en avait commandé 50 000 doses. Le ministère de la Santé a réagi vendredi soir en disant « prendre acte » de la décision de la HAS, et assure que sa commande était conditionnée à l’autorisation précoce de la HAS. « Les échanges avec l’Agence européenne des médicaments (EMA) continuent et une décision européenne concernant la demande d’autorisation de mise sur le marché est attendue début d’année 2022 », précise le communiqué du ministère.
Un nouveau traitement aux anticorps monoclonaux autorisé
La HAS a en revanche autorisé l’utilisation de l’Evusheld (tixagévimab-cilgavimab), du laboratoire AstraZeneca. Le traitement est conçu pour les patients de 18 ans et plus à très haut risque de forme sévère de la Covid-19 et qui sont mal ou pas protégés par la vaccination et ceux qui n’y sont pas éligibles. Il est administré par voie intramusculaire et son efficacité est obtenue 14 jours après son administration. Selon les résultats consultés par la HAS, le traitement réduit l’incidence des cas d’infections symptomatiques d’environ 80% et apporte une durée de protection d’au moins six mois après l’administration d’une dose unique.
En raison d’un risque cardiovasculaire identifié lors des essais cliniques, il est recommandé de ne pas administrer Evusheld aux personnes ayant au moins deux facteurs de risque cardiovasculaire (dyslipidémie, diabète, obésité, hypertension, tabagisme, âge avancé…).
Covid-19: le Molnupiravir finalement écarté en traitement précoce par la HAS
Présentée par le gouvernement comme un outil-clé contre le coronavirus, la pilule produite par le laboratoire Merck ne convainc pas les autorités sanitaires.
Par Paul Guyonnet 10/12/2021 21:35 CET

CORONAVIRUS – ”Il y a un game changer, et c’est le Molnupiravir.” Voici ce que déclarait, le 26 octobre dernier lors d’une audition au Sénat, le ministre de la Santé Olivier Véran au sujet de la pilule supposément miracle pour lutter contre le covid-19. Un traitement oral capable donc de “changer la donne”, pour traduire le ministre. Sauf qu’il y un hic…
Alors que la France s’était très rapidement positionnée pour acquérir 50.000 doses, les essais cliniques se sont révélés décevants. En effet, selon les chiffres avancés par le laboratoire américain Merck, à l’origine du traitement, le médicament ne réduit le risque d’hospitalisation pour les personnes à risque atteintes du Covid que de 30% après la prise du médicament.
Dans le détail, d’après l’essai mené par l’entreprise, 9,7% des 700 personnes dans le groupe placebo avaient été hospitalisées, contre 6,8% dans le groupe traité avec la pilule Lagevrio.
Des résultats insatisfaisants
Un premier revers auquel s’est ajouté, ce vendredi 10 décembre, un second avec le refus de la Haute autorité de Santé d’approuver ce traitement.
#Communiqué | La HAS se prononce sur deux nouveaux traitements de la #Covid19 pour des patients à risque de faire une forme sévère : Evusheld® d’AstraZeneca et Lagevrio® de MSD France.
👉 https://t.co/HyG2IgPzqKpic.twitter.com/gW2sEvE8b2— Haute Autorité de santé (@HAS_sante) December 10, 2021
Pour se justifier, l’instance donne plusieurs arguments, parmi lesquels l’efficacité somme toute relative du Molnupiravir. “Les résultats avancés par le laboratoire sont moins bons que ceux des traitements disponibles: 30% de réduction des risques de progression vers les formes graves de la maladie alors que l’efficacité pour les anticorps monoclaux casirivimab-imdevimab est d’environ 80% sur ce même critère”, écrit la HAS dans son communiqué.
Et l’instance d’ajouter que la “discordance importante” entre les premiers et les résultats finaux l’a influencée dans sa décision.
La variable Omicron
Des éléments qui font dire à la Haute autorité qu’une autorisation du Molnupiravir “risquerait d’induire une perte de chance pour les patients, qui ne se verraient pas traités par un traitement disponible et plus efficace”, en l’espèce le Ronapreve développé par Regeneron.
Autre argument contre la pilule de Merck avancé par la Haute autorité de Santé, l’incertitude liée au variant Omicron. “L’Agence nationale de sécurité du médicament a conclu, considérant le contexte épidémique actuel de la 5e vague du covid-19 et le potentiel impact du variant Omicron sur les options thérapeutiques existantes, que l’efficacité et la sécurité de ce médicament étaient présumées dans une indication restreinte par rapport à celle revendiquée par le laboratoire”, peut-on lire.
En clair que les essais réalisés en laboratoire en-dehors du contexte de l’émergence du variant n’étaient pas nécessairement réplicables dans le monde réel. Raison pour laquelle la HAS “considère que ce médicament ne remplit pas les critères pour obtenir une autorisation d’accès précoce”.
Pilule anti-Covid-19 : la France a commandé 50 000 doses de Molnupiravir fabriquées par l’américain Merck
Le ministre de la santé, Olivier Véran, a dévoilé cette commande de molnupiravir, un traitement antiviral contre le Covid-19 en cours d’examen par les autorités sanitaires.
Le Monde avec AFP Publié le 26 octobre 2021 à 14h24 – Mis à jour le 26 octobre 2021 à 17h56
Temps de Lecture 4 min.

Il pourrait changer la donne dans la lutte contre l’épidémie. Alors que les autorités sanitaires européennes examinent ce traitement antiviral qui pourrait être crucial dans la lutte contre l’épidémie, le ministre de la santé, Olivier Véran, a annoncé, mardi 26 octobre, lors d’une audition au Sénat, que la France a commandé 50 000 doses de la pilule anti-Covid-19 du laboratoire américain Merck. Lors de cette même audition, M. Véran a également dit que deux tiers des soignants étaient maintenant vaccinés.
La France a de nouveau atteint 5 000 contaminations quotidiennes au SARS-CoV-2 : les chiffres de Santé publique France publiés lundi montrent que les contaminations repartent à la hausse depuis le 20 octobre. Si on lisse les chiffres sur une semaine, lundi a été le troisième jour d’affilée où le nombre de nouveaux cas quotidiens s’établit au-dessus de 5 000. Il y en avait 5 084 samedi, 5 259 dimanche et 5 293 lundi, alors que cet indicateur ne dépassait pas 4 700 cas jusqu’au 19 octobre.
Le gouvernement et les épidémiologistes ont insisté ces dernières semaines sur la nécessité de maintenir les gestes barrières pour contenir la pandémie, malgré les bénéfices de la vaccination.
- 50 000 doses du traitement contre le Covid-19 de Merck commandées
« Cinquante mille doses de ce médicament vont être livrées à la France à compter des derniers jours de novembre ou des premiers jours de décembre, c’est-à-dire dès que les traitements sortiront des chaînes de production », a déclaré Olivier Véran mardi.
Merck, appelé MSD en dehors de l’Amérique du Nord pour le distinguer d’un homonyme allemand, a fait état au début d’octobre de résultats très encourageants pour cet antiviral. Selon le laboratoire américain, qui a effectué des essais sur près de 800 patients mais doit encore en rendre publics les détails, le molnupiravir diminue par deux les risques d’hospitalisation quand il est donné à des patients qui viennent d’être testés positivement au Covid-19. Le groupe a demandé l’autorisation du traitement aux autorités sanitaires américaines comme européennes, ces dernières ayant annoncé lundi qu’elles entamaient une procédure accélérée.
Selon M. Véran, ce médicament a pour intérêt majeur d’être pris sous forme orale et pourrait donc être utilisé de manière bien plus facile que les traitements intraveineux comme, par exemple, ceux à base d’anticorps de synthèse. « Imaginez que nous ayons eu [au début de la crise sanitaire] un traitement antiviral qui réduisait de 50 % le nombre de cas graves, imaginez l’impact sanitaire dans notre pays au cœur de la première et de la deuxième vague, on aurait eu beaucoup moins de décès et beaucoup moins de cas graves », s’est félicité le ministre. Il a toutefois rappelé que ce traitement ne saurait constituer la seule réponse à l’épidémie, insistant sur l’importance de la vaccination contre le Covid-19.
« Vaccination plus traitement antiviral plus anticorps monoclonaux égale impact sanitaire bien moindre », a-t-il insisté. Cet ensemble « nous mettrait aussi (…) à l’abri en cas de vague épidémique liée à un nouveau variant dont on ignore encore les dégâts qu’il pourrait provoquer », a-t-il conclu. Le coût du traitement sera a priori élevé. M. Véran n’a pas précisé le montant de la commande mais, à titre d’exemple, les Etats-Unis ont commandé cette année 1,7 million de doses pour 1,2 milliard de dollars, soit environ 700 dollars (602 euros) pour chacune.
Lire aussi Pilule anti-Covid-19 de Merck : l’Agence européenne des médicaments lance un examen accéléré
- Un tribunal ordonne la réouverture des bars et restaurants en Guyane
Le tribunal administratif de Guyane a suspendu, lundi, un arrêté du préfet interdisant l’ouverture des bars et restaurant en ville, estimant que la situation de l’épidémie s’améliorait « depuis quatre semaines » sur le territoire. Le tribunal avait été saisi pour la deuxième fois en référé-liberté par un syndicat de restaurateurs et de gérants de bar et l’union syndicale des opérateurs touristiques.
Un juge des référés du tribunal administratif de la Guyane a suspendu, lundi soir à Cayenne, deux articles de l’arrêté de mesures de freinage du préfet. Le premier article suspendu empêchait les établissements de type N (restaurants, débits de boissons) d’ouvrir en Guyane dans les zones classées « orange » (zones urbaines). Le second article, relatif au couvre-feu, visait à permettre aux clients de se rendre au sein de ces établissements.
Le juge a rapporté que son ordonnance prendrait effet dans les 36 heures, encourageant donc le préfet à prendre un nouvel arrêté permettant aux restaurants et bars d’ouvrir dans les zones urbaines, le soir jusque 22 h 30, en semaine comme en zone verte, ainsi que le dimanche.
- Deux tiers des soignants suspendus désormais vaccinés
« Des premières remontées dont je dispose, les deux tiers des soignants suspendus sont revenus au travail une fois vaccinés. C’est bien », a déclaré Olivier Véran lors d’une audition au Sénat sur le projet de loi sur la vigilance sanitaire.
« On est donc à un taux de couverture vaccinale des salariés des établissements sanitaires et médico-sociaux qui est extrêmement élevé, et un taux de suspensions et de démissions qui est extrêmement faible », a-t-il poursuivi, sans dire combien de suspensions sont en cours. La ministre déléguée à l’autonomie, Brigitte Bourguignon, avait précisé le 20 octobre à l’Assemblée nationale qu’à cette date 7 930 soignants étaient suspendus en France.
Déjà obligés depuis le 15 septembre de justifier d’au moins une injection, les salariés des hôpitaux, cliniques et maisons de retraite, ainsi que les soignants libéraux, aides à domicile, pompiers et ambulanciers, soit 2,7 millions de travailleurs, doivent depuis le 15 novembre attester d’un « schéma complet » de vaccination, sous peine de suspension de leur contrat de travail, sans rémunération.
Pilules anti-Covid-19 : que sait-on de ces nouveaux traitements ?
PODCAST
Les laboratoires Merck et Pfizer ont chacun annoncé avoir mis au point un traitement antiviral efficace contre le Covid-19 : le Molnupiravir et le Paxlovid. Florence Rosier et Nathaniel Herzberg, journalistes scientifiques au « Monde », nous expliquent en podcast leurs atouts et leurs limites.
Par Adèle PonticelliPublié le 22 novembre 2021 à 05h00
ÉCOUTEZ L’ÉPISODE DU 22 NOVEMBRE 2021
https://open.spotify.com/embed/episode/2gDh5Uq6jRZoT7TZgOueCT?utm_source=generator&theme=0
Ce sont les derniers arrivés dans la boîte à outils de la lutte contre le Covid-19 : les pilules antivirales. A quelques semaines d’intervalle, deux laboratoires ont annoncé avoir élaboré des traitements, qui, s’ils sont pris rapidement, permettent d’éviter les formes graves du Covid-19. D’abord le laboratoire Merck, avec le molnupiravir, dont l’Agence européenne des médicaments vient d’approuver l’utilisation en cas d’urgence. Puis le laboratoire Pfizer, avec le Paxlovid
Dans cet épisode du podcast « L’Heure du Monde », Florence Rosier et Nathaniel Herzberg, journalistes scientifiques au Monde, reviennent sur l’efficacité annoncée et les limites de chacun de ces traitements.
Covid-19: le traitement Ronapreve (casirivimab et imdevimab) autorisé en préventif pour les immunodéprimés, mais 1700€ la dose
Selon la HAS, il existe 130.000 patients immunodéprimés en France « ne répondant pas à un schéma vaccinal complet et ainsi concernés par ce traitement ».
Selon la HAS, il existe 130.000 patients immunodéprimés en France « ne répondant pas à un schéma vaccinal complet et ainsi concernés par ce traitement ».
PRÉVENTION – Les personnes immunodéprimées, qui courent un risque important de développer une forme grave de Covid et chez qui les vaccins ne fonctionnent pas bien, pourront recevoir préventivement un traitement par anticorps monoclonaux, notamment si elles sont cas contact, ont annoncé ce vendredi 6 août les autorités sanitaires.
“La HAS rend une décision accordant une autorisation d’accès précoce” au traitement Ronapreve (casirivimab et imdevimab) “en prophylaxie pré-exposition ou post-exposition au Sars-CoV-2 chez des patients immunodéprimés qui ne sont pas protégés malgré une vaccination complète”, indique la Haute autorité de santé dans un communiqué.
“On estime qu’en France, 130.000 patients immunodéprimés sont non-répondeurs à un schéma vaccinal complet et ainsi concernés par ce traitement”, précise-t-elle.
L’accès précoce est une procédure qui permet à certains patients de bénéficier d’un médicament avant qu’il ne reçoive une autorisation de mise sur le marché pour l’indication concernée.
Il est octroyé par la HAS, en s’appuyant sur un avis scientifique de l’Agence nationale de sécurité du médicament (ANSM), qui évalue le rapport bénéfice-risque présumé des médicaments.
Lutter contre la réplication du virus
Le Ronapreve était autorisé en accès précoce depuis mars, mais uniquement pour des patients à haut risque de forme grave déjà contaminés par le coronavirus, en phase précoce de l’infection.
Ce traitement, développé par la biotech américaine Regeneron, en partenariat avec le laboratoire Roche, associe deux anticorps monoclonaux dirigés spécifiquement contre la protéine S (spike ou spicule) du Sars-CoV-2. Ils agissent en empêchant la pénétration du virus dans les cellules, luttant ainsi contre sa réplication.
Les personnes sévèrement immunodéprimées, telles que celles ayant reçu une greffe d’organes et qui suivent un traitement immunosuppresseur anti-rejet, les dialysés chroniques et les patients atteints de certains cancers et maladies auto-immunes inflammatoires, ont un risque très élevé de forme grave de Covid et de mortalité en cas d’infection.
Leur système immunitaire ne répondant pas ou seulement partiellement aux vaccins contre le Covid, il est recommandé de leur injecter trois doses. Mais même avec cette précaution, beaucoup ne développent pas suffisamment d’anticorps pour être protégés.
Covid-19. Quatre questions sur les traitements par anticorps approuvés par le régulateur européen

https://www.ouest-france.fr/sante/virus/coronavirus/covid-19-quatre-questions-sur-les-traitements-par-anticorps-approuves-par-le-regulateur-europeen-95f12760-4306-11ec-b56f-a7c3454c89af
Le Ronapreve, du laboratoire suisse Roche avec la biotech américaine Regeneron et le Regkirona, de la société sud-coréenne Celltrion, ont été approuvés par l’Agence européenne du médicament (EMA), jeudi 11 novembre 2021. Ce sont les deux premiers médicaments à recevoir un avis positif de l’EMA à usage humain contre le Covid-19.
Une étape importante
contre la maladie. Les premiers mots de la commissaire européenne à la Santé, Stella Kyriakides, résonnent comme un signe d’espoir. Dans un communiqué, l’agence européenne du médicament (EMA) a annoncé jeudi 11 novembre 2021 avoir approuvé deux traitements par anticorps pour soigner le Covid-19.
Le Ronapreve est développé par la biotech américaine Regeneron en partenariat avec le laboratoire suisse Roche. Recommandé par l’Autorité mondiale de la santé (OMS), il est autorisé depuis le mois de mars dans le traitement du Covid-19 pour des patients présentant un haut risque de développer une forme grave de la maladie. Il a depuis été élargi dans d’autres cas précis, notamment pour les patients hospitalisés non intubés et qui n’ont pas développé naturellement leurs propres anticorps. Le Regkirona, moins connu en Europe, est un traitement de la société sud-coréenne Celltrion et fait déjà l’objet d’une commercialisation en Corée du Sud.
Lire aussi : Traitements contre le Covid-19 : où en sont les essais et quelles pistes sont les plus étudiées ?
Les traitements par anticorps monoclonaux, c’est quoi ?
Les traitements par anticorps monoclonaux sont utilisés depuis plusieurs années pour soigner des maladies auto-inflammatoires chroniques ou certains cancers. Depuis l’apparition du coronavirus, les médecins et scientifiques ont également utilisé cette méthode pour soigner les patients infectés par le Covid-19. Le principe est de trouver des anticorps qui neutralisent complètement le virus, ils sont sélectionnés à partir de patients qui ont guéri du Covid-19 »,
explique Pierre Tattevin, chef du service d’infectiologie du CHU de Rennes (Ille-et-Vilaine), joint par téléphone.
Ces anticorps sont administrés par une perfusion en intraveineuse, en empêchant la pénétration du virus dans les cellules pour lutter contre sa réplication. Le virus serait ainsi neutralisé à la phase précoce de l’infection.
VOIR AUSSI. Covid-19 : les tests PCR et antigéniques sont-ils payants pour les femmes enceintes ?https://www.ultimedia.com/deliver/generic/iframe/mdtk/01124706/zone/1/showtitle/1/src/qxuukr5
Le prix d’une dose du Ronapreve est estimé à environ 1 700 € la dose. Le ministère de la santé, via le site du service public d’information en Santé indique que le coût de ces anticorps est élevé en raison d’un mode de production faisant appel aux biotechnologies et reposant sur un procédé de multiplication artificielle in vitro
. Mais pour le chef du service d’infectiologie de Rennes,si on peut éviter une admission en réanimation grâce au Ronapreve, cela fait faire des économies ».
Il s’agit, selon l’EMA, des premiers médicaments contre le Covid-19 à base d’anticorps monoclonaux à recevoir un avis positif
.
Qui peut en bénéficier ?
L’Agence européenne du médicament recommande, dans son communiqué, l’utilisation du Ronapreve pourles adultes et adolescents ayant contracté le Covid-19 qui n’ont pas besoin d’oxygène supplémentaire et qui présentent un risque de développer une forme sévère ».
Elle précise également qu’il peut être utilisé pour les enfants de plus de douze ans pesant au moins 40 kg ».
PUBLICITÉRéédition de 150 objets issus de collections capsules pour la rétrospective Monoprix.Je découvreJe découvreJe découvreJe découvreJe découvreJe découvreJe découvreJe découvreJe découvreJe découvreJe découvreJe découvreInspired by
Concernant le Regkirona, l’utilisation de ce traitement est réservée uniquement aux adultes infectés par le Covid-19, répondant aux mêmes critères que ceux du Ronapreve.
Aux États-Unis, où il a déjà été approuvé, le Ronapreve a été utilisé pour soigner Donald Trump alors qu’il avait été hospitalisé des suites de son infection au Covid-19.
De son côté, le professeur Pierre Tattevin l’utilise dans son service depuis un peu plus de six mois, notamment dans le traitement précoce des patients Covid non-graves mais atteints de comorbidités et chez des patients à haut risque ».
Actuellement, le Ronapreve peut être prescrit dans quatre indications, autorisées par l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) et la Haute Autorité de Santé (HAS) : en curatif, dans les cinq premiers jours de la maladie, lorsque le patient présente une forme non sévère ou quand le patient fait une forme grave du virus mais n’est pas encore intubé. En préventif, dans le cas d’un patient très à risque et qui est cas contact ou alors pour un patient également très à risque qui n’a pas réussi à développer des anticorps suite au vaccin.
Un signe d’espoir d’une meilleure prise en charge de la maladie ?
Dans ses conclusions, l’EMA affirme que les données sur lesquelles elle appuie sa décision montrent que les traitements avec le Ronapreve ou le Regkirona réduisent significativement l’hospitalisation et la mort des patients atteints du Covid-19 avec des formes sévères
.
Selon une étude citée par le régulateur européen, seulement 0,9 % des patients traités avec du Ronapreve (11 sur 1 192 patients) ont été hospitalisés ou sont décédés dans les 29 jours suivant la prise du traitement. En comparaison, 3,4 % des patients ayant reçu un traitement placebo ont été hospitalisés ou sont décédés.
L’étude scientifique concernant le Regkirona montre également un nombre plus faible de patients nécessitant une hospitalisation ou qui sont décédés à la suite de la prise de ce traitement. Quatorze patients seulement, sur 446 ayant bénéficié du traitement, ont été hospitalisés, ou ont été mis sous oxygène, ou sont décédés, contre quarante-huit patients (sur 434) ayant eu un traitement placebo.
Pour le Ronapreve et le Regkirona, l’EMA considère que « les bénéfices sont plus importants que les risques ». Pour autant, il n’y a pas 100 % d’efficacité pour le Ronapreve »,
relativise le professeur Pierre Tattevin. Il faut l’utiliser dans les bonnes indications, cela ne sert à rien de le prescrire pour un patient déjà intubé.
Autre crainte selon lui, compte tenu de la cible très précise de ces anticorps monoclonaux, il y a un risque que leur utilisation conduise à sélectionner des virus résistants par mutation
. D’où la nécessité de recontrôler la présence du virus à J + 7 pour tous les patients traités par ces anticorps en curatif. En cas de persistance du virus, la recherche de mutations de résistance à ces anticorps est systématique.
Qu’implique cette approbation ?
Le Comité va maintenant envoyer ses recommandations concernant ces deux médicaments à la Commission européenne qui prendra des décisions juridiques rapidement »,
précise le communiqué de l’EMA, ajoutant qu’elle étudiait actuellement six autres médicamentsqui pourraient recevoir une autorisation de mise sur le marché dans de brefs délais ».
Cette approbation ne doit pas se faire au détriment du vaccin, selon la commissaire chargée de la santé, Stella Kyriakides, qui a rappelé l’importance de la vaccination, seule solution préventive pour sortir de la crise ».
Coronavirus : le gouvernement sous-estime-t-il la 5e vague ?Débattez !
Pour le professeur Pierre Tattevin, cette approbation est plus réglementaire qu’une réelle avancée médicale.Comme nous utilisons déjà le Ronapreve, cela va juste changer les modalités d’accès lorsque nous en avons besoin car aujourd’hui, nous devons remplir une demande spécifique »,
explique-t-il.Mais une fois qu’il aura l’autorisation de mise sur le marché français, nous l’obtiendrons plus facilement
.Covid-19. Quatre questions sur les traitements par anticorps approuvés par le régulateur européen
Covid-19 : cinq questions sur les traitements par anticorps monoclonaux approuvés par l’Agence européenne des médicaments
Le Ronapreve et le Regkirona s’adressent à une catégorie particulière de patients et sont administrés par voie veineuse.
Article rédigé par

France Télévisions
Publié le 12/11/2021 13:38Mis à jour le 12/11/2021 13:46 Temps de lecture : 4 min

La commissaire européenne à la Santé évoque une « étape importante » dans la lutte contre le Covid-19. Pour la première fois, l’Agence européenne des médicaments (EMA) a approuvé la mise sur le marché dans l’Union européenne de deux traitements par anticorps contre le Covid-19, jeudi 11 novembre. Il s’agit du Ronapreve, du laboratoire pharmaceutique suisse Roche, et du Regkirona, de la société sud-coréenne Celltrion. Franceinfo revient sur ces deux traitements en cinq questions.
Comment fonctionnent les anticorps monoclonaux ?
Le principe de ces traitements monoclonaux est d’isoler des anticorps de patients qui ont eu le Covid-19, de les reproduire en laboratoire de façon à pouvoir les injecter à d’autres patients. L’organisme du patient qui reçoit ces anticorps peut ainsi mieux lutter contre la maladie.
La rapidité est cruciale dans ce type de traitement : il doit être administré dans les cinq jours qui suivent l’apparition des premiers symptômes, qui ne doivent pas être graves. « C’est un traitement qui s’adresse aux formes très précoces, avant l’hospitalisation, avant le besoin d’oxygène », a expliqué sur franceinfo Gilles Pialoux, chef du service des maladies infectieuses et tropicales de l’hôpital Tenon, à Paris. Le but est d’intervenir au plus tôt pour éviter des formes graves du Covid-19, des hospitalisations et des décès.
A qui sont destinés ces deux traitements ?
L’Agence européenne du médicament « recommande d’autoriser le Ronapreve chez les adultes et les adolescents (à partir de 12 ans et pesant au moins 40 kg) qui n’ont pas besoin d’oxygène supplémentaire et qui présentent un risque de développer une forme sévère ». Le Ronapreve peut également être prescrit de façon préventive, aux personnes non infectées de 12 ans et plus, pesant plus de 40 kg, selon le communiqué de l’agence(en anglais).
Le Regkirona, peut être administré uniquement aux adultes positifs au Covid-19 qui n’ont pas besoin d’oxygène mais présentent un risque de développer une forme sévère de la maladie.
Patrick Berche, membre de l’Académie de médecine, relève que ces traitements sont « d’abord » destinés aux personnes de plus de 80 ans, « qui par définition sont à très haut risque ». Le microbiologiste mentionne aussi « les patients de 65 à 80 ans qui ont une comorbidité comme un diabète ou une hypertension ». Ces critères se couplent avec la nécessité d’administrer le traitement dans un délai de cinq jours après l’apparition des symptômes. Dans les faits, ces traitements ne concerneront donc qu’un nombre limité de personnes.
Sont-ils déjà utilisés ?
Le Ronapreve est déjà connu en France. La Haute Autorité de santé a donné son feu vert, au début du mois d’août, pour « certains patients immunodéprimés à très haut risque de faire une forme sévère ». Le Ronapreve a été « le premier médicament bénéficiant d’un accès précoce depuis la mise en place de ce dispositif début juillet 2021 », a précisé l’instance. « Il y a environ 1 000 ou 2 000 patients en France qui l’ont reçu », a rapporté Patrick Berche. « On a une autorisation d’accès précoce pour une population immunodéprimée chez laquelle le vaccin ne prend pas. On a fait une dose, deux doses, trois doses et ils n’ont pas d’anticorps, donc ils ont une autorisation d’accès à ce produit injectable », a détaillé Gilles Pialoux.
« Dans mon service, on en a administré déjà à une trentaine de personnes. (…) C’est tout à fait efficace, avec une prévention qui fonctionne. »Gilles Pialoux, chef du service des maladies infectieuses et tropicales de l’hôpital Tenon, à Paris
sur franceinfo
Selon une étude citée par l’EMA, seulement 0,9% des patients traités avec du Ronapreve (11 sur 1 192 patients) ont été hospitalisés ou sont morts dans les 29 jours suivant la prise du traitement. En comparaison, 3,4% des patients qui ont reçu un traitement placebo ont été hospitalisés ou sont morts.
Moins connu en Europe que le Ronapreve, le Regkirona est déjà commercialisé en Corée du Sud, comme le rapportait le HuffPost au mois d’août. Pour le Regkirona, une étude montre aussi que prendre ce traitement diminue nettement les hospitalisations et les décès. Sur 446 personnes ayant bénéficié du traitement, seuls 14 ont été hospitalisées, mis sous oxygène ou sont morts, contre 48 chez les 434 personnes ayant reçu un traitement placebo.
Comment sont-ils administrés ?
Le Ronapreve et le Regkirona sont des traitements bien plus lourds que le Molnupiravir, traitement antiviral qui se prend par voie orale. « Ce sont malheureusement des traitements par voie veineuse qui obligent à une hospitalisation », relève Patrick Berche. « La limite du produit, c’est sa complexité à l’administrer », abonde Gilles Pialoux.
Combien coûtent ces traitements ?
Des ONG ont dénoncé, ces derniers mois, le prix élevé du Ronapreve, qu’elles évaluaient à environ 2 000 dollars (1 700 euros) la dose, relevait l’AFP, le 11 octobre. « C’est assez coûteux », commente Gilles Pialoux.
Il s’agit du « prix habituel d’un médicament de type anticorps, ou même d’un médicament innovant », avait commenté sur franceinfo, dès le mois de février, Hervé Watier, professeur d’immunologie du CHU de Tours. Et d’ajouter : « Ce serait un médicament chimique, ça coûterait aussi cher. Ça coûte entre 1 000 et 2 000 euros, mais c’est un prix habituel. »