Vaccins AstraZeneca : « Le rapport bénéfice/risque reste favorable, car il s’agit d’événements exceptionnels, alors que le bénéfice est avéré et majeur »
Annie-Pierre Jonville-Béra préside le réseau français des centres régionaux de pharmacovigilance. Après la confirmation du risque de thromboses veineuses atypiques, dans de très rares cas, chez des personnes vaccinées par AstraZeneca, elle fait le point sur la surveillance des vaccins anti-Covid-19.
Propos recueillis par Sandrine CabutPublié le 28 mars 2021 à 19h29, mis à jour hier à 08h58

La docteure Annie-Pierre Jonville-Béra est présidente du réseau français des centres régionaux de pharmacovigilance (CRPV), au nombre de 31 sur le territoire. Elle est aussi responsable du CRPV Centre-Val de Loire (CHU de Tours).
Après l’annonce, vendredi 26 mars au soir, de la confirmation du risque de thromboses veineuses atypiques, dans de très rares cas, chez des personnes vaccinées en France par le vaccin AstraZeneca, elle fait le point sur la surveillance des vaccins anti-Covid. La docteure évoque aussi la difficulté des centres à gérer l’afflux de déclarations d’effets indésirables, alors que plus de 10 millions d’injections des trois vaccins actuellement utilisés – les deux autres sont Moderna et Pfizer-BioNTech, Johnson & Johnson a été autorisé le 12 mars, les premières doses devraient arriver après la mi-avril – ont été réalisées dans le pays.
Dans son dernier point de situation, l’Agence nationale de sécurité du médicament (ANSM) évoque neuf cas de thromboses (caillots sanguins) atypiques après vaccination par le produit AstraZeneca, avec deux décès. De quoi s’agit-il exactement ?
Cette problématique, en cours d’examen au niveau de l’Europe, concerne des thromboses veineuses très particulières, à la fois par leur localisation, au niveau des veines cérébrales notamment, et par leur association à une thrombopénie (faible taux de plaquettes dans le sang) ou une coagulation intravasculaire disséminée, qui est un trouble de coagulation. Spontanément, cette association n’est pas classique.
En revanche, le risque de thromboses veineuses habituelles – au niveau des membres inférieurs – et d’embolies pulmonaires n’est pas augmenté par le vaccin AstraZeneca, selon l’évaluation de l’Agence européenne des médicaments [AEM]. C’est également ce que nous constatons en France. Toutes les observations rapportées concernent des personnes qui avaient des facteurs de risque classiques de thrombose veineuse : obésité, contraception…
S’agissant des neuf cas de thromboses atypiques déclarés en France, leur profil est comparable à ceux décrits auparavant dans d’autres pays d’Europe. Ce sont des personnes plutôt jeunes (43 ans en moyenne), qui ont déclaré des symptômes dans les huit à quinze jours suivant la vaccination. Nous commençons à voir ces tableaux cliniques après d’autres pays car nous n’avions pas auparavant une volumétrie suffisante de sujets vaccinés pour voir apparaître des événements aussi rares.
Lire aussi AstraZeneca : des chercheurs norvégiens établissent un lien entre le vaccin et les thromboses
Après des cas suspects dans d’autres pays européens, qui avaient conduit à une suspension temporaire du vaccin AstraZeneca, peut-on désormais affirmer qu’il s’agit d’une complication de cette vaccination ?
L’Agence européenne des médicaments continue d’explorer tous les dossiers, pour tenter d’établir s’il y a un lien ou si l’association est fortuite. Plus le nombre de cas augmente, plus on peut se dire que ce n’est pas le hasard, mais confirmer un lien pour une maladie rare est très complexe. Le cas échéant, il faudra ensuite comprendre le mécanisme en jeu.
Lire le reportage : Vaccination à l’AstraZeneca : « Je fais confiance à mon médecin, je ne sais pas si je l’aurais fait sinon »
A la suite de l’évaluation européenne, une mention sur ces thromboses atypiques a été ajoutée dans le résumé des caractéristiques du produit [RCP] de ce vaccin, et une information a été envoyée aux professionnels de santé à ce sujet. A ce stade, comme l’a confirmé l’AEM, le rapport bénéfice/risque reste favorable, car il s’agit d’événements exceptionnels, alors que le bénéfice est avéré et majeur.
Lire aussi Le vaccin d’AstraZeneca est « sûr et efficace », assure l’Agence européenne des médicaments
Il y a tout de même eu deux décès en France suspectés d’être en lien avec ces thromboses atypiques, dont l’un concerne une sexagénaire et l’autre un étudiant de 25 ans, vacciné dix jours auparavant. Que sait-on du rôle éventuel du vaccin dans la mort de ce jeune homme apparemment sans antécédent médical ?
C’est un dossier médico-légal, donc nous n’avons pas les données. Des examens sont encore en cours. De façon générale, lors d’un décès déclaré en pharmacovigilance, on peut éliminer la responsabilité du médicament si on trouve une autre cause évidente. Encore que… On peut apprendre des années ans plus tard que le produit favorisait la pathologie en question alors qu’on l’ignorait à l’instant T. A l’inverse, affirmer qu’un médicament est la cause d’un décès n’est pas facile non plus. Le plus souvent, c’est gris, pas blanc ou noir.
Si un vaccin, qui s’adresse à des personnes non malades, peut induire des pathologies graves voire des décès, cela remet-il en cause son utilisation ?
Le risque de thrombose atypique étant observé chez des personnes plutôt jeunes, et le bénéfice du vaccin contre le Covid-19 étant plus important chez les personnes âgées (car plus à risque de forme grave), cela explique le choix de la France de réserver le vaccin AstraZeneca aux plus de 55 ans. Au regard des données actuelles, la position de la Haute Autorité de santé [HAS] est légitime et cohérente.
Lire aussi Covid-19 : pourquoi la vaccination avec AstraZeneca est limitée aux plus de 55 ans
Globalement, l’évaluation du rapport bénéfice/risque des vaccins est plus compliquée que pour d’autres médicaments. C’est subtil car il faut prendre en compte le bénéfice individuel et collectif. Tout risque paraît insupportable quand il s’agit d’un traitement préventif, mais ici, le bénéfice est d’éviter une maladie mortelle.
Depuis le début de la vaccination, fin décembre 2020, plus de 17 000 effets indésirables ont été déclarés aux 31 centres régionaux de pharmacovigilance. Comment faites-vous au quotidien ?
Ce chiffre de 17 000 cas correspond aux déclarations saisies dans la base de pharmacovigilance, un certain nombre de cas non graves, c’est-à-dire n’ayant pas nécessité pas de prise en charge médicale, sont en attente. Nous avons désormais environ 3 000 événements par semaine, et cela ne cesse d’augmenter. Il faut gérer aussi tous les appels de professionnels et du public pour des questions diverses sur les vaccins.Lire aussi Les idées claires sur le Covid-19 : les vaccins
Malgré quelques moyens supplémentaires, le système des CRPV est plus qu’en tension, certains chefs de service retraités sont même revenus pour donner un coup de main. L’enjeu est de repérer rapidement les potentiels effets graves dits « marquants », dont on doit informer sans délai l’Agence nationale de sécurité du médicament et les CRPV rapporteurs, au nombre de deux centres par vaccin.
Dans les centres, on priorise les dossiers provenant du portail ou d’appels avec ce qui s’apparente à trois codes couleur. En rouge, les urgents, qu’il faut gérer et saisir en priorité, après un appel au médecin afin de recueillir des informations complémentaires. A l’autre extrémité, il y a les cas jaunes, connus et non graves, dont la saisie peut attendre. Entre les deux, ce sont les dossiers orange où il faut appeler le déclarant pour clarifier l’effet et reclasser ensuite en jaune ou rouge. Enfin, il nous arrive aussi de conseiller les patients : si l’un d’eux déclare des céphalées, qui durent des semaines sans s’améliorer, nous l’appelons pour qu’il consulte rapidement.
Pour anticiper les besoins, nous nous étions fondés sur les expériences du vaccin contre la grippe H1N1 et du Levothyrox, mais ce n’est pas vraiment comparable. A l’époque du vaccin H1N1, en 2009, il n’y avait pas encore de déclaration directe des patients par le portail. Et pour le Levothyrox, il y avait eu un afflux de déclarations des patients, mais la proportion de cas graves était infime alors qu’elle est d’environ 20 % pour les vaccins contre le Covid-19.
Par ailleurs, nous n’avions pas anticipé que le vaccin AstraZeneca était aussi réactogène car en octobre 2020, nous n’avions pas les données des essais cliniques. Chez les jeunes, c’est presque un sur deux qui fait une réaction majeure, avec de la fièvre…
A ce stade, comment faire pour ne pas engorger le système ?
Jusqu’à la semaine dernière, 80 % des dossiers correspondaient à des effets indésirables non graves, connus. Heureusement, leur nombre diminue un peu. Les professionnels de santé et les patients doivent savoir qu’il n’y a pas d’intérêt à déclarer des symptômes attendus de type simple rougeur locale, ou fièvre qui régresse en vingt-quatre heures. Cela n’est pas utile et cela noie le système car nous devons vérifier toutes les déclarations. La mission de la pharmacovigilance, c’est de détecter des effets nouveaux ou graves, qui pourraient amener à changer l’utilisation du médicament, à modifier le rapport bénéfice/risque dans une partie de la population.
Le vaccin n’est pas forcément à l’origine de tous les symptômes que les gens peuvent avoir dans les jours qui suivent, et les médecins ne doivent pas oublier leurs réflexes habituels devant tel ou signe clinique ou anomalie biologique. L’idée est de ne pas attribuer à tort une symptomatologie au vaccin. Par exemple, un vaccin peut entraîner une adénopathie [ganglion] satellite, au niveau du creux axillaire, qui régresse en quelques jours. S’il y a un ganglion un mois après, il faut explorer pour rechercher une cause comme on ferait en l’absence de vaccination.
Une nouvelle base de pharmacovigilance va être mise en service début avril. En pleine pandémie, n’est-il pas risqué de changer le système de recueil des données ?
Aujourd’hui, le système est imparfait et il dysfonctionne du fait de la surcharge. Le nouveau système, attendu depuis plusieurs années, devait arriver avant le déploiement de la vaccination contre le Covid, mais il ne va démarrer effectivement que maintenant. L’avantage de cette base de pharmacovigilance sera d’être interconnectée avec le portail de déclaration des effets indésirables, ce qui évitera de ressaisir certaines données comme le sexe, l’âge. Cela permettra aussi le précodage des déclarations de patients avec un système d’intelligence artificielle. Mais l’écueil est qu’il va falloir former nos assistantes, et pour être en conformité avec l’Europe, elles devront saisir davantage de données.Notre sélection d’articles sur les vaccins contre le Covid-19
Retrouvez tous nos articles sur les vaccins contre le Covid-19 dans notre rubrique.
Covid-19 dans le monde : le vaccin d’AstraZenenca suspendu pour les moins de 60 ans à Berlin et à Munich
L’Italie va imposer une quarantaine à ses visiteurs venus de l’Union européenne, tandis que l’Allemagne renforce ses contrôles aux frontières et suspend, à Berlin et à Munich, le sérum anglo-suédois pour les moins de 60 ans après des cas de thrombose cérébrale.
Le MondePublié aujourd’hui à 13h19, mis à jour à 17h39
Temps de Lecture 5 min.
Les restrictions de circulation s’accentuent au sein de l’Union européenne (UE) alors qu’une partie du continent est frappée par une troisième vague. L’Italie va imposer une quarantaine à ses visiteurs venus de l’UE, tandis que l’Allemagne renforce ses contrôles aux frontières.
La pandémie a fait au moins 2,79 millions de morts dans le monde depuis la fin de décembre 2019, selon un bilan de l’Agence France-Presse (AFP) établi mardi 30 mars à partir de sources officielles. Les Etats-Unis restent le pays comptant le plus de décès avec 550 036 morts, devant le Brésil (313 866), le Mexique (201 826), l’Inde (162 114) et le Royaume-Uni (126 615).
- Le vaccin d’AstraZeneca suspendu à Berlin et Munich pour les moins de 60 ans
L’autorité allemande des vaccins a fait état, mardi, de 31 cas de thrombose veineuse cérébrale (TVC) rare, dont neuf mortels, après l’administration du vaccin contre le Covid-19 d’AstraZeneca. Sur ces 31 cas de caillots sanguins dans le cerveau, 19 présentent des carences en plaquettes sanguines, a précisé l’Institut Paul-Ehrlich (PEI). Tous les cas signalés concernent des femmes âgées de 20 à 63 ans, à l’exception de deux hommes, âgés de 26 et 57 ans.
La ville de Berlin a annoncé, mardi, suspendre « par précaution » l’utilisation de ce vaccin pour les personnes de moins de 60 ans, dans l’attente de nouvelles recommandations nationales.
Dans la matinée, les responsables sanitaires de Munich, troisième ville d’Allemagne, lui ont emboîté le pas en annonçant sur Twitter la suspension « jusqu’à ce que la question de possibles complications soit éclaircie ».
- Des contrôles renforcés aux frontières en Allemagne
L’Allemagne va par ailleurs renforcer, pour les « huit à quatorze prochains jours »,les contrôles autour de ses frontières terrestres, notamment avec la France, le Danemark et la Pologne, sans toutefois les systématiser, pour lutter contre la pandémie, a annoncé mardi le ministre de l’intérieur, Horst Seehofer.
La chancelière allemande, Angela Merkel, a sévèrement rappelé à l’ordre, dimanche, les Länder, les pressant d’appliquer les restrictions pour lutter contre la troisième vague de la pandémie due au coronavirus, alors que plusieurs Etats-régions ont annoncé des assouplissements.
Lire aussi Covid-19 : l’Allemagne durcit les conditions d’accès des Français sur son territoire
- Une quarantaine pour les visiteurs européens entrant en Italie
Une mise à l’isolement durant cinq jours : voilà ce qui attend bientôt les voyageurs venus d’Union européenne souhaitant entrer en Italie. Les visiteurs devront par ailleurs se soumettre à un test avant leur départ et à l’issue de la quarantaine, une mesure qui concerne déjà les pays hors UE. Ce dispositif « s’applique à tous ceux qui partent et arrivent » dans la péninsule, y compris les ressortissants italiens, a précisé un responsable du ministère de la santé. Mais on ignore encore quand elles entreront en vigueur.
Dans une volonté d’afficher son soutien à la campagne de vaccination, le président du conseil (premier ministre), Mario Draghi, 73 ans, a fait savoir qu’il avait reçu, mardi, une dose du vaccin d’AstraZeneca. L’Italie avait suspendu son utilisation durant plusieurs jours en mars en raison de soupçons sur ses effets secondaires, jusqu’à ce que l’Agence européenne du médicament (AEM) ne donne à nouveau son feu vert.

Si l’essentiel de l’Italie est actuellement soumis à de sévères restrictions (fermeture au public des bars et restaurants, déplacements limités, etc.), les écoles du Latium (région qui englobe Rome) ont pu rouvrir mardi après la décision des autorités sanitaires de passer la région de « rouge » (haut risque de contagion) à « orange » (risque moyen). Mais toute l’Italie sera classée en zone « rouge » pour le week-end de Pâques, qui débute samedi et s’achève lundi. La pandémie a jusqu’ici fait plus de 108 000 morts en Italie, selon le ministère de la santé.
- Aucune mort du Covid-19 enregistrée dimanche à Londres
Selon les chiffres de l’agence de santé britannique, Public Health England (PHE), aucun décès lié au Covid-19 n’a été enregistré dimanche 28 mars à Londres. C’est une première dans la capitale britannique depuis le 27 février. Epicentre de la deuxième vague, Londres rassemble 12 % des décès survenus au Royaume-Uni depuis le début de la pandémie. En janvier, elle recensait deux cents morts par jour.
Si, comme en France, le nombre de cas enregistrés le lundi est toujours un peu en dessous de la réalité, ce bilan signe tout de même un très fort ralentissement de l’épidémie dans le pays, où presque 60 % des adultes ont reçu au moins une dose de vaccin. Dans tout le Royaume-Uni, dix-neuf morts ont été rapportés dimanche.
Pour autant, le Royaume-Uni n’est pas décidé à ralentir le rythme de sa campagne de vaccination. Il compte bien en faire bénéficier l’ensemble de sa population adulte avant de distribuer son excédent de doses à d’autres pays, a même annoncé, mardi, sur la chaîne de télévision Sky News, le ministre des entreprises britannique, Kwasi Kwarteng. Pas sûr que l’UE apprécie. Le Royaume-Uni et l’Union sont entrés dans un bras de fer ces dernières semaines sur la question de la répartition des doses.
- Test d’un deuxième vaccin à grande échelle à Cuba
L’île de Cuba a commencé lundi à vacciner 124 000 travailleurs de la santé avec Abdala, son deuxième candidat-vaccin contre le Covid-19, dans le cadre d’un test à grande échelle, selon les autorités locales. Il s’agit de Cubains âgés de 19 à 80 ans présentant « un risque élevé » de contamination du fait de leur profession. Les essais cliniques de phase 3, les derniers avant la validation finale, sont menés parallèlement auprès de 48 000 volontaires.
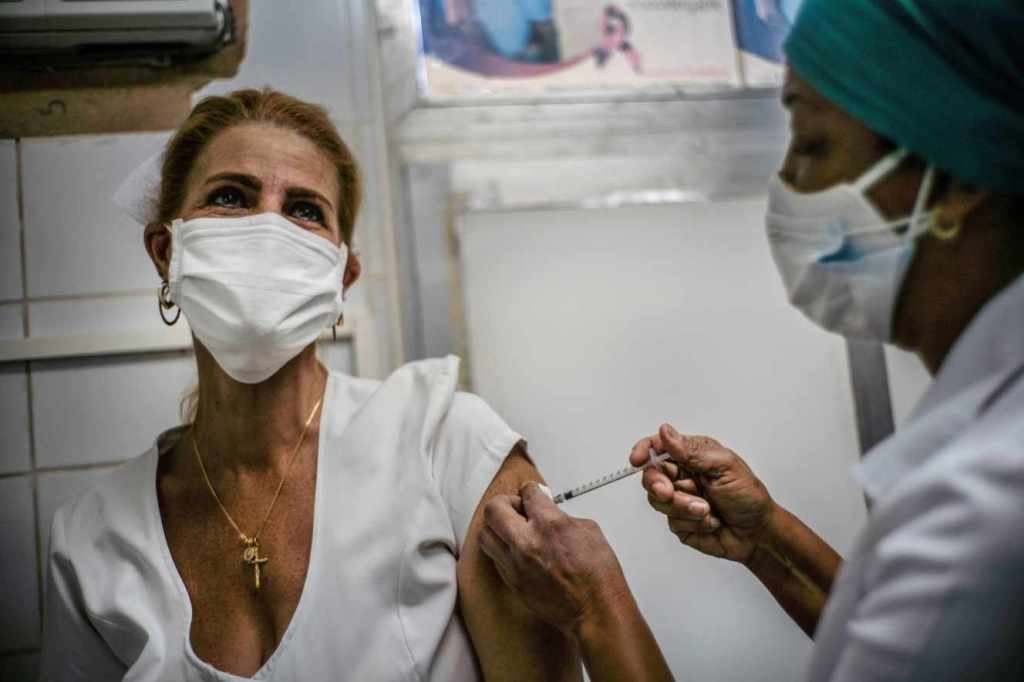
Les autorités cubaines ont également lancé, la semaine dernière, deux autres études d’intervention avec le candidat vaccin Soberana 2, également en phase 3. Le gouvernement cubain prévoit de lancer sa campagne de vaccination en juin, avec ce qui serait alors le premier vaccin contre le coronavirus conçu et produit en Amérique latine.Article réservé à nos abonnés Lire aussi Les médecins, première source de devises de Cuba
- BioNTech-Pfizer veut accroître sa production jusqu’à 2,5 milliards de doses
Le laboratoire allemand BioNTech a annoncé mardi qu’il comptait fabriquer en 2021 jusqu’à 2,5 milliards de doses de son vaccin développé avec l’américain Pfizer, soit 25 % de plus qu’annoncé initialement. Les capacités de production devraient augmenter en raison d’une « optimisation des processus de production », de « l’expansion du réseau de production », ainsi que de l’autorisation de tirer six doses d’un flacon, explique l’entreprise dans un communiqué.
Elle a livré avec son partenaire, en date du 23 mars, « plus de 200 millions de doses » dans le monde. L’homologation la semaine passée d’un nouveau site de production en Allemagne, à Marbourg (sud), doit soutenir la hausse de ces capacités avec une production de 250 millions de doses prévue au premier semestre, pour atteindre à terme un milliard de doses par an.Notre sélection d’articles sur le Covid-19